FDA對(duì)經(jīng)皮給藥系統(tǒng)的監(jiān)管框架以PK-BE、黏附性及刺激/致敏性為核心,兼顧體外評(píng)價(jià)與臨床數(shù)據(jù),旨在對(duì)比療效與安全性。PK-BE可評(píng)價(jià)體內(nèi)吸收速度和程度的差異,黏附性是貼劑發(fā)揮療效的基礎(chǔ),直接影響藥物釋放的穩(wěn)定性和劑量準(zhǔn)確性,皮膚作為直接接觸部位,其安全性風(fēng)險(xiǎn)需嚴(yán)格評(píng)估。
PK-BE和黏附性研究通常合并開展,并在研究過程中可收集貼膏、貼劑單次給藥的刺激性評(píng)分。但單次給藥的刺激性評(píng)分,能否充足代表長期用藥或階段性用藥的皮膚刺激性與致敏性?
本文結(jié)合FDA的透皮和局部給藥系統(tǒng)的刺激性和致敏性獨(dú)立研究的做法,分析其設(shè)計(jì)原理及審評(píng)要求,以給國內(nèi)的研究和監(jiān)管提供參考思路。
概念解析
▍接觸性皮炎
指通過實(shí)驗(yàn)或臨床觀察,評(píng)估某物質(zhì)(如化妝品、藥品、醫(yī)療器械或化學(xué)品)在直接接觸皮膚后,是否可能引發(fā)皮膚炎癥反應(yīng)(刺激性或過敏性)。
▍刺激性
物質(zhì)與皮膚接觸后,因化學(xué)、物理或免疫因素引起的非免疫性炎癥反應(yīng),通常表現(xiàn)為紅斑、水腫、灼痛或組織損傷,一般局限于接觸部位,短期內(nèi)出現(xiàn)和消失。
▍致敏性
物質(zhì)通過反復(fù)接觸誘導(dǎo)免疫系統(tǒng)產(chǎn)生過敏反應(yīng),主要為T細(xì)胞介導(dǎo)的遲發(fā)型超敏反應(yīng)(IV型),通常可表現(xiàn)為丘疹、水泡、劇烈瘙癢,可擴(kuò)散至非接觸部位,通常延遲出現(xiàn),緩慢消退。
評(píng)估方法及原理
▍總體設(shè)計(jì)
總體設(shè)計(jì)隨機(jī)、評(píng)估者盲、受試者體內(nèi)重復(fù),可以選擇參比制劑作為對(duì)照藥或不含藥的載體作為對(duì)照。黏附性可能因外觀差異難以實(shí)現(xiàn)完全的盲態(tài),但皮膚反應(yīng)評(píng)分需要嚴(yán)格做到盲態(tài)[1]。例如,一項(xiàng)評(píng)估Corplex?Donepezil透皮給藥系統(tǒng)(TDS)的皮膚刺激和致敏潛力的研究(NCT03397862)采用了雙盲設(shè)計(jì)[2]。
▍研究流程
研究流程包括篩選期、21天的誘導(dǎo)期、14~17天的休息期及激發(fā)期(貼敷48 h后觀察72 h),對(duì)于潛在致敏性者,需要間隔4~8周后,再次激發(fā)期[1]。誘導(dǎo)期用于評(píng)估多次暴露的皮膚刺激性,激發(fā)期用于評(píng)估致敏性,為實(shí)際臨床使用的安全等效提供數(shù)據(jù)支持。
設(shè)計(jì)原理:
21天的反復(fù)暴露可模擬實(shí)際使用情況,觀察皮膚多次暴露的刺激累積效應(yīng),并且充分激活免疫系統(tǒng)。參與過敏反應(yīng)的朗格漢斯細(xì)胞需要多次抗原提呈以充分激活T細(xì)胞,21天可覆蓋初次致敏和記憶T細(xì)胞的形成時(shí)間。
休息期(14~17天)確保T細(xì)胞分化成熟,確保記憶細(xì)胞穩(wěn)定存在,并且可避免誘導(dǎo)期殘留炎癥干擾激發(fā)期結(jié)果(如假陽性)。
IV型超敏反應(yīng)(T細(xì)胞介導(dǎo))的峰值在接觸后48~72小時(shí)。48小時(shí)接觸可覆蓋反應(yīng)高峰,準(zhǔn)確評(píng)估遲發(fā)型炎癥。觀察時(shí)長72小時(shí),可以區(qū)別致敏性和刺激性。初次激發(fā)后間隔4~8周再次接觸,可驗(yàn)證免疫記憶是否長期存在。皮膚表皮細(xì)胞的生長周期為28天,4~8周間隔確保皮膚免疫系統(tǒng)恢復(fù)基線狀態(tài)。確保過敏現(xiàn)象僅由記憶細(xì)胞響應(yīng)產(chǎn)生。
▍給藥方案與劑量
考慮需要同時(shí)給予受試制劑和對(duì)照制劑,需要結(jié)合說明書用法用量確認(rèn)給藥面積(如利多卡因凝劑貼膏、雙氯芬酸依泊胺貼使用1/4貼)。背部、上臂和前臂屈側(cè)皮膚有較多樹突狀細(xì)胞,以背部為最佳給藥部位。例如多奈哌齊透皮貼說明書用藥部位包括背部、上臀部、大腿外側(cè),但刺激性致敏性研究選擇背部給藥。受試制劑和對(duì)照制劑應(yīng)分布在同一解剖部位對(duì)側(cè)位置。
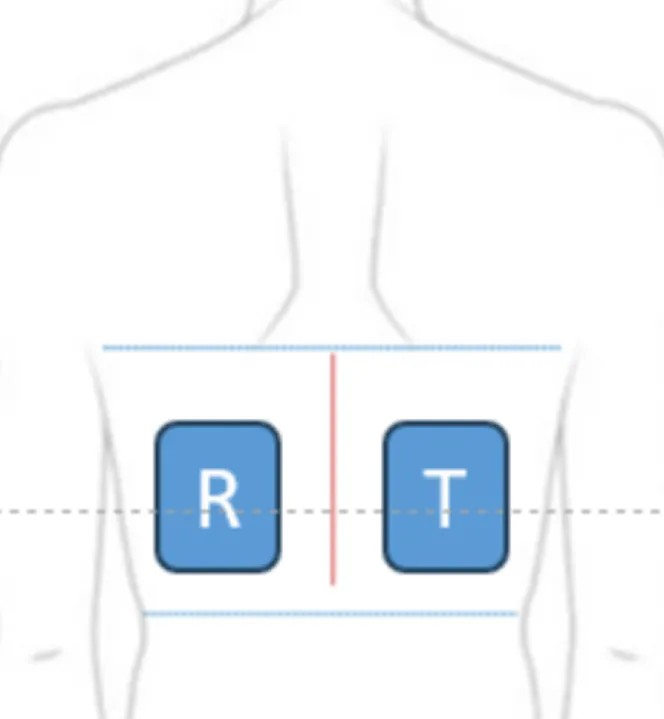
一般選擇18~65周歲健康的男性和非孕女性,特殊品種應(yīng)選擇其用藥人群,如雌二醇貼采用絕經(jīng)期婦女進(jìn)行試驗(yàn)。FDA指導(dǎo)原則要求至少200例可評(píng)價(jià)的受試者[1]。該試驗(yàn)周期長,脫落風(fēng)險(xiǎn)高,通常按脫落率30%計(jì)算,需入組260例左右。
重點(diǎn)排除受試者[1]:
妊娠期或哺乳期女性;
有顯著皮膚疾病或狀況的病史,如特應(yīng)性體質(zhì)、銀屑病、白癜風(fēng),或已知會(huì)改變皮膚外觀或生理反應(yīng)的情況(例如,糖尿病或卟啉病)
有會(huì)顯著影響免疫反應(yīng)的病史(例如,原發(fā)性或獲得性免疫缺陷,如HIV或艾滋病;過敏性疾病,如過敏性休克、哮喘或全身性藥物反應(yīng);腫瘤,如淋巴瘤或白血病;類風(fēng)濕性關(guān)節(jié)炎;或系統(tǒng)性紅斑狼瘡)
有顯著皮膚癌的病史(例如,黑色素瘤或鱗狀細(xì)胞癌),淺表且未涉及透皮給藥系統(tǒng)(TDS)應(yīng)用部位的基底細(xì)胞癌除外;
在研究治療開始前3周內(nèi),使用可能會(huì):(1)顯著影響或夸大對(duì)T或R產(chǎn)品的反應(yīng),或(2)改變對(duì)T或R產(chǎn)品的炎癥或免疫反應(yīng)的藥物或治療(例如,環(huán)孢素、他克莫司、全身或局部皮質(zhì)類固醇、細(xì)胞毒性藥物、免疫球蛋白、卡介苗免疫療法、單克隆抗體或放射治療);
在研究治療開始前72小時(shí)內(nèi),使用抗組胺藥或在TDS部位使用局部藥物;
)受試者兩臂/左右背之間皮膚顏色存在明顯差異,或存在皮膚狀況,如應(yīng)用部位的過多毛發(fā)、疤痕組織、紋身、開放性傷口、曬傷或身體穿孔(如紋身、穿耳洞等)可能干擾測(cè)試物品的使用、皮膚評(píng)估或受試者對(duì)透皮給藥系統(tǒng)(TDS)的反應(yīng)。
另外,可參考國內(nèi)《人體皮膚斑貼試驗(yàn)技術(shù)指導(dǎo)原則(征求意見稿)》[3]中受試者的選擇標(biāo)準(zhǔn)。
▍評(píng)價(jià)指標(biāo)及要求[1]
FDA推薦采用皮膚反應(yīng)量表(皮膚反應(yīng)+其他反應(yīng))進(jìn)行皮膚反應(yīng)評(píng)分,采用黏附性評(píng)分表進(jìn)行黏附情況記錄,評(píng)分量表見表1~表3。
誘導(dǎo)期每次去除TDS后30 min評(píng)價(jià),激發(fā)期應(yīng)在移除后30 min、24 h、48 h和72 h評(píng)估皮膚反應(yīng)及是否致敏。
表1皮膚反應(yīng)評(píng)分表

表2其他反應(yīng)評(píng)分表
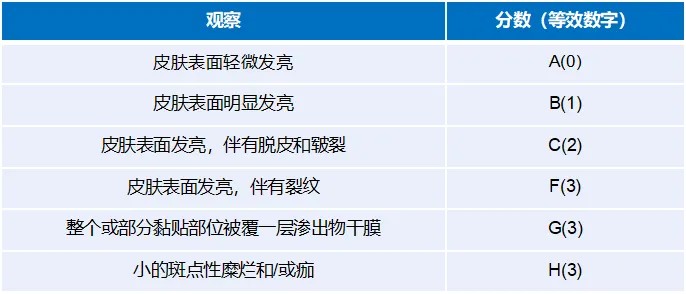
表3黏附性得分評(píng)價(jià)表

致敏性:主要評(píng)價(jià)每貼T或R可能過敏的參與者數(shù)量和比例及過敏的參與者數(shù)量和比例,評(píng)估T和R致敏率相當(dāng)。可能致敏的評(píng)價(jià)標(biāo)準(zhǔn):①參與者至少有一個(gè)評(píng)估時(shí)間點(diǎn)出現(xiàn)在激發(fā)期制劑移除后24 h以上(例如48或72 h);②參與者在激發(fā)期的最后一次評(píng)估中的綜合刺激評(píng)分至少為2分;③如果參與者完成了兩次激發(fā)期試驗(yàn),兩次試驗(yàn)結(jié)果需都滿足上述兩條標(biāo)準(zhǔn)。
黏附性:評(píng)價(jià)數(shù)據(jù)用于監(jiān)測(cè)適當(dāng)激發(fā)誘導(dǎo)I/S必要的皮膚接觸的充分性,并不要求進(jìn)行非劣統(tǒng)計(jì),但需要在研究方案中預(yù)先規(guī)定使用膠帶或覆蓋物加固任何可脫離TDS的標(biāo)準(zhǔn)。
總結(jié)
美國是全球唯一要求經(jīng)皮給藥系統(tǒng)做獨(dú)立的膚刺激性與致敏性人體研究的國家,而我國目前還沒有類似的指導(dǎo)原則。
國家藥品監(jiān)督管理局藥品審評(píng)中心2021年3月發(fā)布的《皮膚外用化學(xué)仿制藥研究技術(shù)指導(dǎo)原則(試行)》,提出了逐步遞進(jìn)的對(duì)比研究策略,首先進(jìn)行仿制藥與參比制劑藥學(xué)全面對(duì)比研究,并在非臨床安全性研究的基礎(chǔ)上,進(jìn)行臨床等效性研究,但沒有涉及刺激性和致敏性研究要求。國家藥品監(jiān)督管理局藥品審評(píng)中心2022年5月發(fā)布的《局部給藥局部起效藥物臨床試驗(yàn)技術(shù)指導(dǎo)原則》的“結(jié)語”中,雖然提及“局部給藥局部起效藥物的臨床試驗(yàn)中,應(yīng)特別關(guān)注對(duì)局部藥代、局部藥效、局部安全性、耐受性等的充分探討”,但該文件也并未涉及具體的刺激性和致敏性研究要求。
經(jīng)皮給藥制劑的成分和組成,包括原料藥的性質(zhì)和(或)經(jīng)皮給藥材料阻止水蒸氣從皮膚發(fā)散的程度,以及其他因素,如環(huán)境濕度或皮膚狀態(tài),可能刺激皮膚或?qū)е轮旅舴磻?yīng)。刺激性和致敏性可能只在少數(shù)使用該產(chǎn)品的患者中發(fā)生,但即使這種情況發(fā)生的頻率很低,不良反應(yīng)也可能影響數(shù)千人。刺激性與致敏性研究對(duì)于實(shí)際臨床應(yīng)用具有重要意義,值得我們?nèi)ヌ接懞脱芯俊?br /> 參考文獻(xiàn)
[1]FDA.Assessing the Irritation and Sensitization Potential of Transdermal and Topical Delivery Systems for ANDAs Guidance for Industry.April 2023 Generic Drugs Revision 1
[2].NCT03397862.https://clinicaltrials.gov/
[3]中國食品藥品檢定研究院.人體皮膚斑貼試驗(yàn)技術(shù)指導(dǎo)原則(征求意見稿).2023年4月
[4]國家藥品監(jiān)督管理局藥品審評(píng)中心.局部給藥局部起效藥物臨床試驗(yàn)技術(shù)指導(dǎo)原則.2022年5月
[5]國家藥品監(jiān)督管理局藥品審評(píng)中心.皮膚外用化學(xué)仿制藥研究技術(shù)指導(dǎo)原則(試行).2021年3月


